NEOPLASIA NEUROENDOCRINA DE COLON Y RECTO
Es una patología neoplásica primaria de estirpe epitelial que muestra diferenciación, tanto morfológica como de inmunofenotipo, de tipo neuroendocrino. De aparición esporádica o más raramente asociado a síndromes familiares. También se ha relacionado su aparición a procesos inflamatorios de larga evolución como la enfermedad inflamatoria intestinal. Se clasifican empleando el esquema de la OMS 2019 en: Tumores neuroendocrinos (NET), carcinomas neuroendocrinos (NEC) y neoplasias neuroendocrinas-no neuroendocrinas mixtas (MiNEN).
- Preferentemente en recto (entre tercios medio y distal; otros reportes señalan una localización de 5 a 10cm por encima de la línea dentada).
- También se pueden localizar en sigmoides y ciego más que en otras áreas de colon.
- Conviene resaltar que las neoplasias neuroendocrinas de apéndice no se tratan en este apartado.
- En colon: Puede presentarse como:
- Lesiones tumorales únicas de aspecto submucoso, redondeadas, con tonalidad amarillenta, en ocasiones más oscura (rojiza), que pueden alcanzar los 5cms.
- Las neoplasias neuroendocrinas de colon derecho presentan aspecto tumoral más comúnmente.
- Lesiones polipoides, pequeñas de 2 a 3mm, de color amarillo.
- En recto:
- Usualmente tiene tamaño menor de 20mm pudiendo presentarse con una morfología variada (lesiones sésiles, tipo submucosa, umbilicada o polipoide).
- Presentación más común: lesiones polipoides pequeñas de tonalidad beige que sobre eleva la mucosa.
- Cabe resaltar que características endoscópicas como erosión, hemorragia o un tamaño mayor a 2 cm, sugiere una neoplasia neuroendocrina pobremente diferenciada.
- Población neoplásica de crecimiento infiltrativo y de localización predominantemente submucosa con ocasional extensión a base de mucosa.
- NET:
- Células neoplásicas uniformes con núcleo redondo u oval con cromatina en "sal y pimienta" y baja razón núcleo-citoplasma.
- Nucleolo inconspicuo y sin atipia.
- Mitosis infrecuentes y por lo general sin necrosis.
- Patrones arquitecturales:
- Organoide (patrón A): Distribución a modo de islas o nidos. Más frecuente en colon.
- Trabecular (patrón B): Distribución acintada o reticular. Más frecuente en recto.
- Acinar (patrón C)
- Patrón de células pequeñas (patrón D): Disposición difusa acompañado de necrosis en ocasiones. Infrecuente en NETs.
- No es raro identificar varios patrones en una misma lesión.
- NEC: Pueden tener dos tipos de presentación:
- Tipo células pequeñas:
- Núcleos fusiformes, hipercromáticos, amoldados con empalizada periférica y escaso citoplasma.
- Actividad mitótica intensa, apoptosis, necrosis e invasión vascular.
- Distribución en sábanas sólidas (patrón E) o nidos.
- No suele tener nucléolo prominente ni pleomorfismo.
- En ocasiones, puede identificarse efecto Azzopardi.
- Tipo células grandes:
- Núcleos grandes, vesiculares, con cromatina gruesa y nucléolo prominente.
- Citoplasma eosinofílico, de distribución organoide.
- Numerosas mitosis y necrosis frecuente.
- Tipo células pequeñas:
- MiNEN:
- Requisito histopatológico: identificación de al menos 30% de cada componente en la lesión.
- Combinaciones posibles: neoplasias de estirpe neuroendocrina (NET o NEC) y no neuroendocrina (Ej. adenocarcinoma, carcinoma escamoso o adenoma).
- Combinación más frecuente en colon: adenoma/adenocarcinoma-NEC.
- Proteína que participa en la sinapsis.
- Positividad citoplásmica, indica diferenciación neuronal y neuroendócrina.
- En neoplasias neuroendocrinas de colon suelen ser positivas.
- Proteína que participa en la liberación de diferentes graninas.
- Positividad citoplásmica granular, indica diferenciación neuronal, endócrina y neuroendocrina.
- Positividad variable principalmente a la cromogranina A, en particular los NECs.
- NETs rectales de células L podrían resultar negativos para cromogranina A (producen cromogranina B).
- Factor de transcripción de homeobox nuclear responsable del desarrollo de células epiteliales intestinales.
- Patrón de tinción nuclear.
- Positivo en neoplasias neuroendocrinas de colon y recto a excepción de las derivadas de células L.
- Enzima citoplasmática expresada en células y tumores neuroendocrinos.
- Patrón de tinción citoplasmático.
- Expresión positiva incluso en tumores neuroendocrinos pobremente diferenciados.
- Glicoproteína de unión homofílica con función en la adhesión célula-célula.
- Patrón de tinción de membrana.
- Mayor positividad en colon derecho que en colon izquierdo y recto.
- Receptores acoplados de proteína G.
- Patrón de tinción de membrana y citoplasma.
- Posibles factores pronósticos para predecir la supervivencia.
- Proteína nuclear expresada en las fases activas del ciclo celular.
- Patrón de tinción nuclear, indica proliferación celular.
- Esencial para gradación.
- Derivado del procesamiento post trasduccional del péptido proglucagón.
- Patrón de tinción citoplasmático.
- Positivo en NETs rectales de células L.
- Considerar su solicitud ante negatividad para CDX2 y serotonina.
- Péptido de 36 aminoácidos producido por células PP del páncreas.
- Patrón de tinción citoplasmático.
- Positivo en NETs rectales de células L.
- Considerar su solicitud ante negatividad para CDX2 y serotonina.
- Neurotransmisor y hormona.
- Patrón de tinción citoplasmático.
- Positivo en NETs rectales de células C.
- Proteína de unión de factor de transcripción.
- Patrón de tinción nuclear.
- Diferencia origen apendicular y rectal del pancreático.
- Isoenzima de fosfatasa ácida.
- Patrón de tinción citoplasmático.
- Diferencia origen rectal de NETs de células L de su origen apendicular.
Para plantear el diagnóstico de neoplasia neuroendocrina se requiere:
- Identificar las características histológicas previamente descritas. No existe un score que indique cuántas características son necesarias, pero empíricamente se da mayor importancia al monomorfismo nuclear y a las características citológicas.
- Comprobar la positividad a la inmunohistoquímica característica (cromogranina, sinaptofisina y Ki-67 como inicio).
Clasificación OMS 2019:
- Tumores neuroendocrinos (NET): Neoplasias neuroendocrinas bien diferenciados.
- En colon tienen peor pronóstico en relación a su contraparte rectal.
- Subtipos en recto:
- NETs rectales de células L: Tumores productores del PP/PYY. Más frecuentes en recto (ocasionalmente en sigmoides distal). Generalmente lesiones pequeñas (<1cm). Arquitectura trabecular o pseudo glandular con citología blanda.
- NETs rectales de células EC: Tumores productores de serotonina.
- Carcinomas neuroendocrinos (NEC): Neoplasias neuroendocrinas pobremente diferenciadas.
- Representan alrededor de la mitad de los NENs en colon.
- Subtipos:
- Tipo células pequeñas
- Tipo células grandes: Más frecuente en NECs de colon (grandes sábanas de células grandes con necrosis).
- Neoplasias neuroendocrinas-no neuroendocrinas mixtas (MiNEN): Grupo heterogéneo con diferentes características según componentes.
- Tumor neuroendocrino (NET): Según índice mitótico y Ki-67.
- Carcinoma neuroendocrino (NEC): Por definición es de alto grado (índice mitótico >20/mm2 e índice de Ki-67 >20%).
- Neoplasias neuroendocrinas-no neuroendocrinas mixtas (MiNEN): Estratificación pronóstica según componentes:
- MiNENs de bajo grado de malignidad: Combinación de adenoma y NET (MANET).
- MiNENs de grado intermedio: Compuesto por adenocarcinoma y NET.
- MiNENs de alto grado: Combinación de NEC con adenoma/adenocarcinoma (MANEC) o NEC con carcinoma escamoso.
- La gradación se realiza definitivamente en la pieza quirúrgica.
- Assarzadegan N, Montgomery E. What is New in the 2019 World Health Organization (WHO) Classification of Tumors of the Digestive System: Review of Selected Updates on Neuroendocrine Neoplasms, Appendiceal Tumors, and Molecular Testing. Arch Pathol Lab Med. 2021;145(6):664-677.
- Volante M, Grillo F, Massa F, et al. Neuroendocrine neoplasms of the appendix, colon and rectum. Pathologica. 2021;113(1):19-27.
- Albertelli M, Grillo F, Lo Calzo F, Puliani G, Rainone C, Colao AAL, Faggiano A; NIKE group. Pathology Reporting in Neuroendocrine Neoplasms of the Digestive System: Everything You Always Wanted to Know but Were Too Afraid to Ask. Front Endocrinol (Lausanne). 2021 Apr 23;12:680305.
- College of american pathologists. Protocol for the Examination of Specimens From Patients With Neuroendocrine Tumors (Carcinoid Tumors) of the Colon and Rectum. : February 2020.
- Ahmed M. Gastrointestinal neuroendocrine tumors in 2020. World J Gastrointest Oncol. 2020 Aug 15;12(8):791-807.
- La Rosa S, Sessa F, Uccella S. Mixed Neuroendocrine-Nonneuroendocrine Neoplasms (MiNENs): Unifying the Concept of a Heterogeneous Group of Neoplasms. Endocr Pathol. 2016 Dec;27(4):284-311.
- Bosolino A, Ratto R. Tumores neuroendocrinos de colon y recto. Acta Gastroenterol Latinoam. 2018;48:328–38.
- P. Deprez, L. Moons, et al Endoscopic management of subepithelial lesions including neuroendocrine neoplasms: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2022; 54(04): 412-429.
- Janet L. Cunningham, Lars Grimelius, Anders Sundin, Smriti Agarwal & Eva T. Janson (2007) Malignant ileocaecal serotonin-producing carcinoid tumours: The presence of a solid growth pattern and/or Ki67 index above 1% identifies patients with a poorer prognosis, Acta Oncologica, 46:6, 747-756.
- Ogimi T, Sadahiro S, Kamei Y, Chan LF, Miyakita H, Saito G, Okada K, Suzuki T, Kajiwara H. Distribution of Neuroendocrine Marker-Positive Cells in Colorectal Cancer Tissue and Normal Mucosal Tissue: Consideration of Histogenesis of Neuroendocrine Cancer. Oncology. 2019;97(5):294-300.
- Wang Y, Wang W, Jin K, Fang C, Lin Y, Xue L, Feng S, Zhou Z, Shao C, Chen M, Yu X, Chen J. Somatostatin receptor expression indicates improved prognosis in gastroenteropancreatic neuroendocrine neoplasm, and octreotide long-acting release is effective and safe in Chinese patients with advanced gastroenteropancreatic neuroendocrine tumors. Oncol Lett. 2017 Mar;13(3):1165-1174.
- Maione F, Chini A, Milone M, Gennarelli N, Manigrasso M, Maione R, Cassese G, Pagano G, Tropeano FP, Luglio G, De Palma GD. Diagnosis and Management of Rectal Neuroendocrine Tumors (NETs). Diagnostics (Basel). 2021 Apr 25;11(5):771.
Imágenes
Neoplasia Neuroendocrina de Colon y Recto
Figura 1. Vista general de neoplasia neuroendocrina
Figura 2. Cromatina en "sal y pimienta" característica
Figura 3. Patrón organoide (nidos)
Figura 4. Patrón trabecular
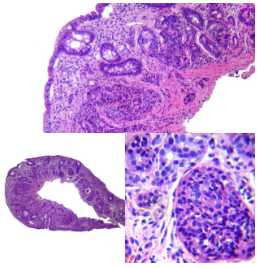
Figura 5. NEC de células pequeñas
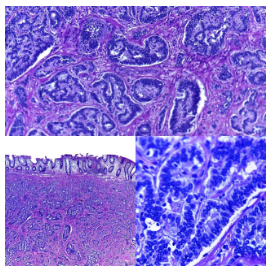
Figura 6. NEC de células grandes
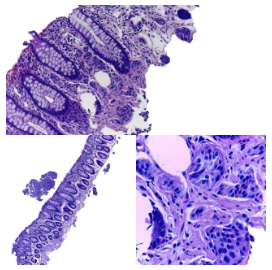
Figura 7. Tinción sinaptofisina positiva
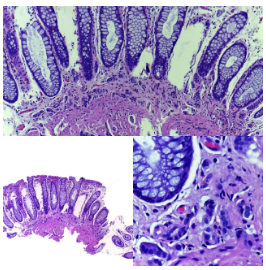
Figura 8. Tinción cromogranina positiva
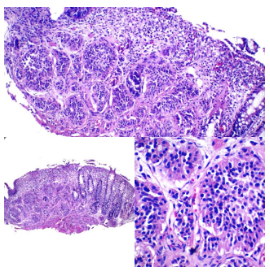
Figura 9. Tinción Ki-67 para gradación

